Brief an Politiker
Kategorie: Politik & Rechtliches -->
In der Plastischen Chirurgie läuft seit Jahrzehnten leider einiges unter dem Radar und so mit falsch! Allerdings kann man nicht den Ärzten, die die Schönheits-Op durchführen, die Schuld daran geben, sondern den Patientenschützern.
Der Brief wurde von Melanie Fröhlich lange recherchiert und an Patientenschützer in Deutschland und Europa adressiert. So entstand diese Homepage. Ursprünglich wollten wir nur diesen Brief veröffentlichen und dann kam mehr und mehr Inhalt auf diese Homepage. Dennoch umfasst der Brief immer noch alle Missstände und ist heute leider noch aktuell. Wenn Dir der Text zu fielst, lies nur die Überschriften. Der Inhalt ist auch mit den Überschriften zu verstehen. Oder schau Dir unser Video auf YouTube
an. In diesem kurzen Video werden die Missstände ähnlich wie in diesem Brief kurz erläutert.
Du kannst den Brief hier als PDF in der Originalform herunterladen:
Die Antworten des BfArMs sind leider sehr unbefriedigend. Der erste Brief war eine Rechtfertigung, dass sie sich an geltende Gesetze halten. Auf unsere konkrete Nachfrage, warum sie denn nicht erkennen, dass uns die Gesetze nicht ausreichend schützen - kam eine sehr herablassende Antwort. Sie würden jetzt von weiteren Erläuterungen absehen und wir könnten sicher sein, dass die den Patientenschutz ernst nehmen. So ernst, dass seit mehr als 9 Monaten keine Up-Date mehr zum Thema BIA-ALCL geschrieben wurde.
Empfängerliste:
Kurt Racké (stellvertretender Vorsitzender des Arbeitskreises Med. Ethikkommissionen)
Michèle Rivasi (Grünen-Abgeordnete im EU Parlament)
Prof. Dr. Claudia Schmidtke (Patientenbeauftragte der Bundesregierung)
Dr. Katarina Barley (Bundesministerin der Justiz und für Verbraucherschutz)
Dr. Wolfgang Lauer (Leiter der Forschungsgruppe „Medizinproduktesicherheit“)
Jens Spahn (Gesundheitsminister)
Dr. Doris Pfeiffer (Vorstandsvorsitzende GKV-Spitzenverband)
Bundesgesundheitsministerium (Presse)
Risiken von Brustimplantaten
Sehr geehrte Damen und Herren,
mein Brief richtet sich gezielt an mehrere Personen und/oder Institutionen, die öffentlich für den Schutz von Patienten einstehen. Er ist bewusst ausführlich recherchiert und geschrieben, um die Wichtigkeit des Themas im gesamten Kontext zu untermauern. Obwohl dieses Thema sehr emotional für mich ist, wollte ich auf Pauschalaussagen verzichten und vielmehr meine Forderungen in einen nachvollziehbaren Kontext bringen. Als BII‑Betroffene (Breast Implant Illness – Brustimplantatkrankheit), schreibe ich im Namen vieler BII betroffenen Frauen und möchte Sie eindringlich bitten, meinen Brief aufmerksam zu lesen, meine markierten Fragen (entsprechend für Ihren Verantwortungsbereich) zu beantworten und für die Beseitigung der beschriebenen Missstände einzustehen.
BII und ASIA (Autoimmune/Inflammatory Syndrome Induced bei Adjuvants = durch Hilfsstoffe induziertes Autoimmun- / Entzündungssyndrom) sollten Ihnen spätestens nach der Anhörung der FDA (US Food & Drug Administration) am 25./26. März 2019 ein Begriff sein, obwohl in Deutschland insgesamt kaum jemand davon gehört hat. In Beratungsgesprächen zu Brustaufbau mit Implantaten wird immer noch von lebenslanger Haltbarkeit und zu vernachlässigenden Risiken gesprochen. Kapselfibrose sei das einzige Risiko, mit einer Wahrscheinlichkeit von weniger als 3%. Wollen Sie es länger hinnehmen, dass solche Falschaussagen getroffen werden?
Es gibt ausreichende Beweise dafür, dass Implantate weit schlimmere Gesundheitsfolgen haben als angenommen und kommuniziert.
Zunächst erzähle ich meine persönliche Geschichte.
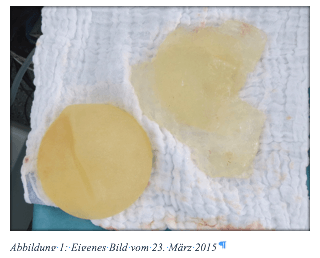
Meine Implantate ließ ich mir 2007, genau mit dieser in trügerischer Sicherheit gewogenen Information, einsetzen. Der damalige Arzt sagte mir, dass dies die besten und neuesten Implantate auf dem Markt seien. Da es sich um kohäsives Material handele, wäre ein Auslaufen ausgeschlossen. In 2010 fing meine Krankengeschichte mit einer Schilddrüsenunterfunktion an. Bis zu diesem Zeitpunkt war ich voller Energie, lebensfroh und vor allem nie krank, ganz zu schweigen von einer Schilddrüsenkrankheit. Meine Ursachenforschung endete mit einer eineinhalb Jahre langen Arbeitsunfähigkeit nach zahlreichen nicht bestätigten Verdachtsdiagnosen. Meine Ärzte waren ratlos und meinten, meine Beschwerden kämen vom Stress. Die Frage nach einem Zusammenhang mit den Implantaten wurde immer verneint, da selbst Ärzte nicht richtig informiert sind oder die Augen verschließen. Durch Selbstdiagnosen und ein MRT fand ich heraus, dass eines meiner Implantate defekt war. Im März 2015 ließ ich beide Implantate (Eurosilicone) wiederum gegen die besten, neuesten Implantate (Polytech-Texturiert, Verkauf seit einigen Wochen in Frankreich eingestellt), dieses Mal mit dem Gütesiegel „Made in Germany“ mit der CE‑Zertifizierung, austauschen.
Meine gesundheitlichen Beschwerden waren nach drei bis sechs Monaten restlos verschwunden. Doch leider fingen diese im Winter 2017, also pünktlich nach drei Jahren, wieder an – mal mehr, mal weniger. Wiederum durch Selbstdiagnosen und soziale Medien erkannte ich, dass ich an BII erkrankt war. Ich bin fassungslos, dass Aufklärung offensichtlich lediglich im Internet unter den Betroffenen stattfindet und nur wenige Ärzte hinter uns stehen. Ich appelliere an Ihre Verantwortung. Hätte ich vor zwölf Jahren all die mir heute bekannten Informationen gehabt, hätte ich mich niemals für einen Brustaufbau mit Implantaten entschieden.
Meldet ein Arzt ein Vorkommnis in Bezug auf Brustimplantate nicht, bleibt dies ohne Rechtsfolgen. Ein Bekanntwerden wird somit erschwert.
Zahlreiche Ärzte wissen mittlerweile von den Risiken, aber in Beratungsgesprächen werden diese heruntergespielt. Ich selbst habe von Chirurgen in den Beratungsgesprächen zur Explantation (März 2019) gehört, dass ich ein trauriger Einzelfall sei und sie davon noch nicht gehört hätten. Lediglich einer der Ärzte erinnerte sich: „Jetzt wo Sie es sagen, hatte ich mal einen Fall, der drei Monate nach Implantation Schuppenflechte am ganzen Körper entwickelt hatte. Nach Entnahme verschwand diese Schuppenflechte.“ Eine Meldung des Vorfalls geschah in diesem Fall nicht, obwohl § 3 Absatz (2) bis (4) MPSV besagt, dass „aufgetretene Vorkommnisse“ der zuständigen Bundesoberbehörde zu melden sind. Diese oben beschriebene Frau mit Schuppenflechte hatte Glück, dass ihr Körper so schnell reagierte und sie das Gift sofort wieder los war. Leider melden Ärzte nicht! Wenn eine Betroffene meldet, interessiert sich die Bundesoberbehörde dabei lediglich für Medizinproduktefehler (dazu unten mehr) der Implantate, nicht aber für BII. Ich stelle mir also die Frage, was passiert, wenn ein Arzt diese Vorkommnisse nicht meldet? In diesem Fall also gegen geltendes Recht verstößt?
Zigtausende betroffene Frauen tauschen sich in den sozialen Medien darüber aus, was Brustimplantate ihrer Gesundheit zugefügt haben.
Viele andere Frauen reagieren leider erst nach Jahren oder Jahrzehnten. Ich kenne mindestens 30 Frauen persönlich und Zigtausende aus Facebook, die an BII erkrankt sind. Im Krankenhaus (bei meiner Explantation im Mai 2019) traf ich eine Frau, sie hatte 17 Jahre lang Implantate. Die ersten zehn Jahre waren beschwerdefrei, doch dann entwickelte sie Knieschmerzen, Muskel- und Gelenkschmerzen und zum Schluss war sie nicht mehr in der Lage, ihre Wasserflasche eigenständig zu öffnen. Sie lief von Arzt zu Arzt und landete, so wie ich auch in der Psychosomatik-Ecke. Sie fand durch einen „Akte Bericht“ (Sat1) eine Facebook-Gruppe mit mehr als 860 betroffenen Frauen (Stand Mai 2019). „Sie hätte niemals damit gerechnet, dass die Implantate Schuld an ihrem Gesundheitszustand sind. Auch ihre Ärzte versicherten ihr, dass es keinen Zusammenhang gäbe.“ Drei Tage nach der Entnahme ihrer intakten (keine Ruptur) Implantate, saß ich mit ihr im Krankenhaus in der Cafeteria, sie öffnete eine Wasserflasche und sprach darüber, dass ihre Schmerzen deutlich zurückgegangen seien. Fast täglich findet eine Frau (wie diese) ihren Weg in diese Facebook-Gruppe und realisiert, dass die Beschwerden der letzten Jahre nur auf ihre Implantate zurückzuführen sind, denn alles andere wurde ohne Befund bereits untersucht.
Die Aufklärung über Risiken findet durch knapp 100.000 Frauen in Facebook-Gruppen statt.
Dank der sozialen Medien, wo sich mittlerweile in verschiedenen Facebook-Gruppen (Stand Mai 2019: Krank durch Brustimplantate in Deutschland mehr als 860 Frauen, Breast Implant Illness in den USA mehr als 79.000 Frauen und weiteren Gruppen in Kanada, Australien, etc.) Frauen mit identischen Beschwerden zusammengeschlossen haben, konnte auch dieser Frau geholfen werden. Die Dunkelziffer ist weit größer, denn nicht jede Implantatträgerin nutzt die sozialen Medien und verlässt sich so weiterhin auf die Falschaussagen der Ärzte.
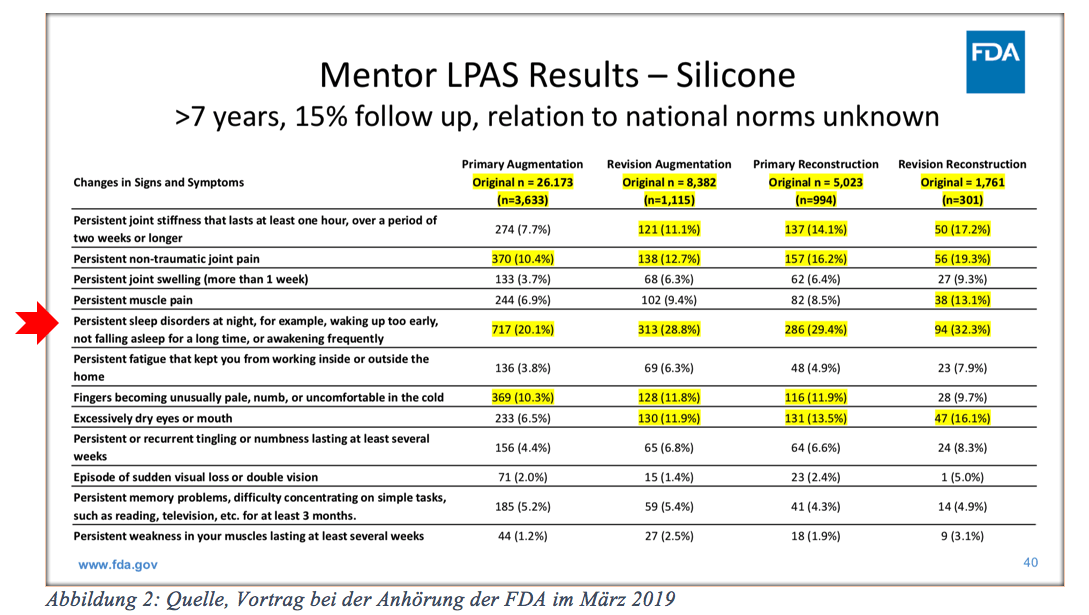
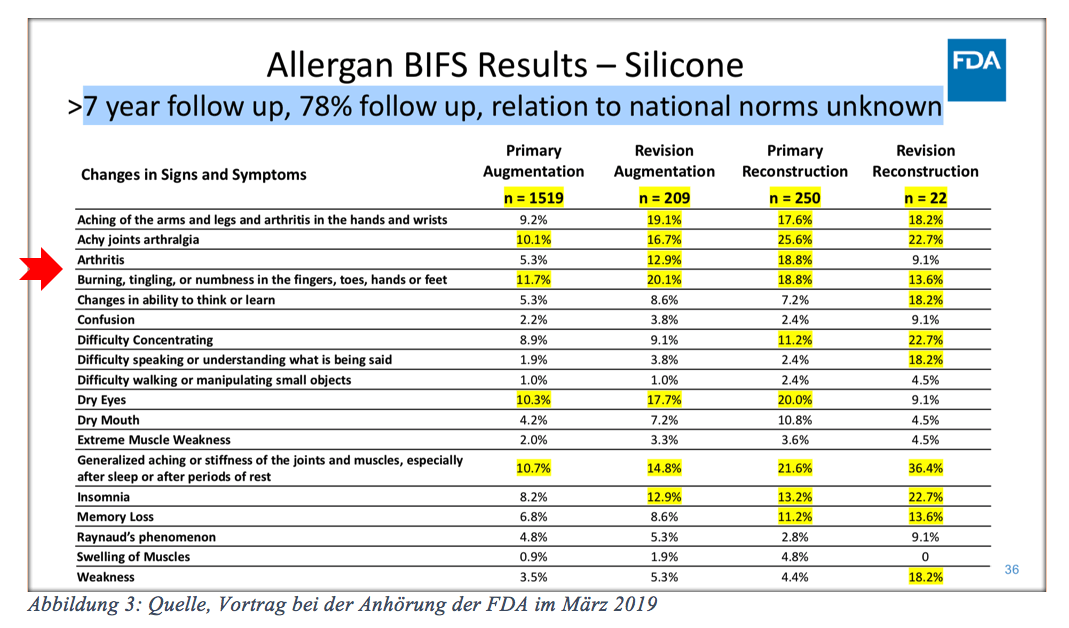
Bei der FDA wurden erschreckende Studien mit Aussagen wie z.B. Muskelschmerzen bei ca. 20 % der Implantatträgerinnen kommuniziert.
Deshalb fordere ich Sie auf, nach Kenntniserlangung der erschreckenden Beweise bei der FDA‑Anhörung, endlich tätig zu werden. Es sind bereits fast zwei Monate vergangen, und in Deutschland sorgt niemand für Aufklärung. In Beratungsgesprächen zu Brustaufbau mit Implantaten wird immer noch von lebenslanger Haltbarkeit gesprochen, Bioverträglichkeit, kein Zusammenhang mit Autoimmunerkrankungen, und es wird versichert, dass kein Silikon in den Körper gelangen kann. Bei der Anhörung haben zahlreiche Ärzte das Gegenteil bewiesen.
Welche Häufigkeit veranlasst Sie dazu, es als zu kommunizierendes Ergebnis zu veröffentlichen? Gelenkschmerzen (Joint Pain) mit über 10 %,
Muskelschmerzen von bis zu 20 % und Schlaflosigkeit mit bis zu 30 %.
Packungsbeilagen von Medikamenten weisen Risiken als „sehr selten“ aus, wenn diese Nebenwirkung bei 0,01 % liegt. Bei teilweise nachgewiesenen Gelenkschmerzen von ca. 20 % besteht keine Pflicht, dies als Nebenwirkung zu kennzeichnen.
Es ist anzunehmen, dass Sie die Risiken als so gering ansehen, dass eine Information darüber für den Nutzer dieser Medizinprodukte nicht relevant ist. Bei Arzneimitteln hingegen muss jede noch so kleine Nebenwirkung im Beipackzettel stehen. Wenn man diese Angaben über Mentor und Allergan also in einen Beipackzettel übersetzen würde, müsste man schreiben, dass Gelenkschmerzen „sehr häufige“ Nebenwirkungen von Implantaten sind. Anstelle sich für aufklärende Hinweise starkzumachen, ignorieren Sie die neuen Erkenntnisse der Anhörung bei der FDA. Wie ist dazu Ihre Stellungnahme?
Zum Thema ALCL wurde klar bewiesen, dass diese Krankheit nur bei Implantatträgerinnen entstehen kann. Frankreich hat sofort gehandelt und den Verkauf von texturierten Implantaten verboten. Ihre Meinung dazu habe ich gelesen und finde sie erschreckend. Warum ist der Verkauf weiterhin erlaubt?
Weiterhin werden aus meiner Sicht irreführende Pressemitteilungen veröffentlich. Polytech beruft sich auf die Empfehlung der FDA, die kein Verbot aussprach. Es wird aber mit keiner Silbe erwähnt, dass die „derzeit verfügbaren Daten“ auf die Verteilung zwischen texturiert und nicht texturierten Implantaten in den USA reflektieren, nicht aber auf das Risiko selbst. In den USA werden schon seit Jahren kaum noch texturierte Implantate genutzt. Man geht davon aus, dass weniger als 10 % texturiert sind. In Deutschland ist es aber genau andersherum der Fall. Mit der Aussage in der Pressemitteilung wird der Verbraucher wieder in die Irre geführt.
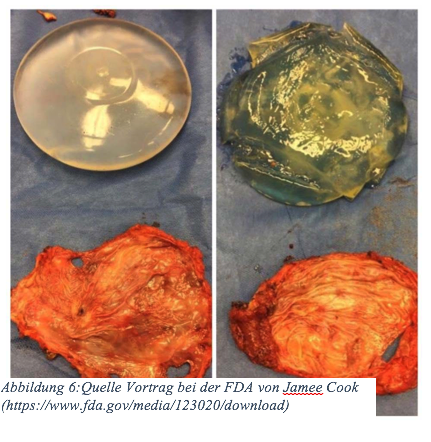
Im Dezember 2018 wurde bekannt, dass Allergan-Implantate im Körper zu einer honigartigen Flüssigkeit werden können.
Sie erhalten weltweit zahlreiche Hinweise, wie gefährlich Brustimplantate für den menschlichen Körper sein können. Aber auf EU‑Ebene dauert es knapp fünf Jahre, bis eine neue Verordnung erlassen wird und weitere drei Jahre, bis sie schlussendlich im Mai 2020 in Kraft tritt.
Währenddessen zeichnete sich ein weiterer Skandal ab. Allergan-Implantate werden nach Jahren zu einer honigartigen Flüssigkeit im Körper. Das Ausmaß der gesundheitlichen Folgen muss ich an dieser Stelle nicht ausführen. Was muss noch passieren, dass Sie sich endlich für Patientenrechte einsetzen?
Sie erhalten unfassbare Beweise und anstatt Patientenrechte zu schützen, schützen Sie die Solidargemeinschaft.
Der Schutz des Solidaritätsprinzips in Bezug auf Brustimplantate misst mit zweierlei Maß.
Der Schutz der Solidargemeinschaft ist grundsätzlich wichtig, aber hier wird mit zweierlei Maß gemessen. Raucher wissen längst, weil sie darüber ausreichend informiert werden, dass Rauchen zahlreiche Risiken birgt. Dennoch werden die Folgekrankheiten, beispielsweise COPD (Chronisch obstruktive Lungenerkrankung) von der Gesetzlichen Kankenversicherung übernommen. Aber Patienten, die sich der gesundheitlichen Folgen nicht bewusst sein konnten, weil die Aufklärung dazu unzureichend ist, müssen sich an den Kosten beteiligen – wenn die medizinische Notwenigkeit überhaupt anerkannt wird. Leider gibt es in diesem Zusammenhang schon die ersten Probleme. Die meisten Ablehnungsschreiben, die ich gesehen habe, zweifelten die medizinische Notwendigkeit an. Die Kapselfibrose sei nicht stark genug, die Muskel- und Gelenkschmerzen könnten auch andere Ursachen haben, eine Ruptur begründe noch keine medizinische Notwendigkeit und Angstzustände, weil etwas auf die Brust drückt, müssten von einem Psychologen behandelt werden. So lange die Explantation auf Grund von BII nicht anerkannt wird, werden die Krankheitskosten durch die Symptome weiterhin das Solidaritätsprinzip belasten. BII ist heilbar, aber dazu unten mehr.
Gesetzliche Krankenversicherungen beteiligen den Versicherten mit der Begründung, sich die Krankheit selbst zugezogen zu haben, obwohl keine Aufklärung zu diesen Krankheiten stattfand.
Beim Wettbewerbsstärkungsgesetz in 2007 wurde der § 52 (2) SGBV eingeführt. Dieser fordert eine Beteiligung des Patienten, wenn man nach kosmetischer Operation krank wird. Also haben Sie offensichtlich erkannt oder sogar aufgrund von steigenden Folgeoperationen beweisen können, dass Implantate nicht sicher sind und gesundheitliche Schäden hervorrufen können. Vom Schutz des Patienten kann hier wohl nicht die Rede sein wenn man lediglich eine Eigenbeteiligung einführt, ohne die Aufklärungspflichten zu schärfen.
„Leistungsbeschränkung bei Eigenverschulden“ – so heißt es. Verschulden kann man in Fahrlässigkeit und Vorsatz unterteilen. Vorsatz regelte schon der § 52 SGBV vor 2007 und gilt nur für den heute geltenden Absatz (1). Somit schaue ich mir an, was eigentlich Fahrlässigkeit per Gesetz heißt. In § 276 (2) BGB heißt es: „Fahrlässig handelt, wer die im Verkehr erforderliche Sorgfalt außer Acht lässt“. Wenn ich als Patient also einen Beratungsbogen lese und unterschreibe, habe ich offensichtlich nicht die im Verkehr erforderliche Sorgfalt verletzt. Nachvollziehbar in diesem Zusammenhang ist für mich noch, dass Folgebehandlungen aufgrund von Komplikationen der kosmetischen Operation mit diesem Paragrafen ausgeschlossen sind, schließlich ist mir klar, dass Wundheilungsstörungen behandelt werden müssen. Im Vergleich dazu sind Krankheiten, die durch den Einsatz des Medizinproduktes entstehen, wohl nicht als Verschulden des Patienten zu sehen. Der Patient ist an den Kosten angemessen zu beteiligen, wenn er sich die Krankheit durch eine ästhetische Operation zugezogen hat. Wir haben uns unsere Krankheit nicht durch die Operation zugezogen, sondern durch den Einsatz eines von Ihnen zugelassenen Medizinproduktes!
Können Sie mir erklären, wie Sie in diesem Kontext Verschulden im Kausalzusammenhang mit der kosmetischen Operation kommunizieren? Wie begründen Sie die Ablehnung, wenn ich durch das Medizinprodukt und nicht durch die kosmetische Operation erkrankt bin? Wollen Sie weiter ablehnen oder den Patienten an den Kosten beteiligen und riskieren, dass der Gesundheitszustand von an Implantaten erkrankten Frauen sich weiter verschlechtert?
Der Patient ist schuld an einer Krankheit, über dessen Existenz er nie aufgeklärt wurde. BII, ASIA, BIA-ALCL, Autoimmunreaktionen und Allergien sind mittlerweile bekannt und werden von den Ärzten immer noch verheimlicht und derart heruntergespielt, dass Patienten davon keine Kenntnis erlangen. Ich gehe sogar noch weiter. Großbritannien schlägt der EU eine Verwendungsbeschränkung für zwei in der Kosmetikanwendung sehr verbreitete Inhaltsstoffe vor. Es handelt sich um die cyclischen Siloxane D4 und D5. Also handelt es sich offensichtlich um schädliche Stoffe. Wie weiß ich als Verbraucher, ob diese Stoffe in meinen Implantaten enthalten sind, wenn die Inhaltsstoffe strengen Betriebsgeheimnissen unterliegen?
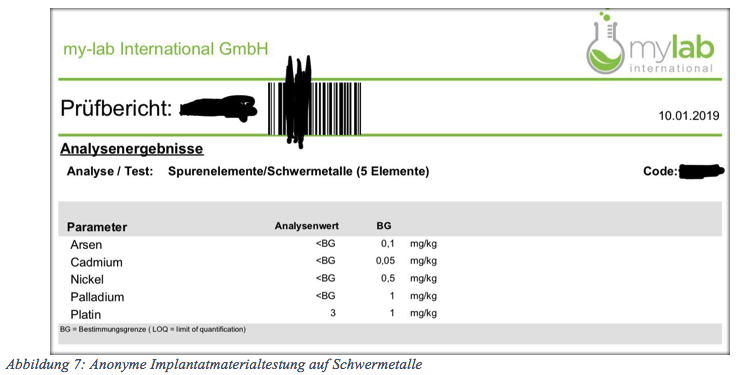
Implantate können eine Schwermetallbelastung (Vergiftung) hervorrufen.
Ein Bekannte hat ihre Implantate auf ein paar Schwermetalle untersuchen lassen und dabei herausgefunden, dass Platin oberhalb der Bestimmungsgrenze enthalten war.
Ich bin davon überzeugt, dass Platin in dieser über den zulässigen Grenzen gesundheitsschädigend sein kann. Ich weiß nicht, wem dieses Risiko bekannt gewesen sein soll. Richter berufen sich auf allgemein bekannte Gefahren.
Beim Blick in ein Ablehnungsschreiben zu Folgekrankheiten durch ein Medizinprodukt (Brustimplantat) bin ich fassungslos. Risiken lägen nicht außerhalb jeder Lebenserfahrung. Vielmehr könne die Gefahr von Folgeschäden bei Brustimplantaten als allgemein bekannt unterstellt werden. Darauf berufen Sie sich also.
Allgemein bekannt? Wenn ich mir die Homepages von plastischen Chirurgen anschaue, fällt auf, dass die gesundheitlichen Folgen offensichtlich noch nicht bei Ärzten als „allgemein bekannt“ anerkannt werden können. Wie können Sie davon ausgehen, dass wir Patienten die allgemein bekannten Risiken kennen?
Ärzte informieren weiterhin, dass Rheuma nicht durch Implantate hervorgerufen werden kann, obwohl es medizinische Studien gibt, die eine Risikoerhöhung von 45 % sehen.
So lange solche Aufklärungen nicht verboten werden – so lange wird es die allgemeine Verharmlosung geben. Was gehört also insgesamt zu den Aufklärungspflichten eines Arztes? Das OLG Karlsruhe hat in seiner Entscheidung vom 20.4.2016 (Az. 7 U 241/14) eine Konkretisierung vorgenommen. Demnach hat der Arzt über begrenzte Haltbarkeit von 10 bis 15 Jahren („individuelle Verschiedenheit“), Implantat-ruptur, Gel-Bleeding, Beschädigung des Implantats durch einen Unfall und engmaschige Kontrolle der Implantate nach zehn Jahren hinzuweisen. Beim Blick in diesen Aufklärungsbogen fällt schnell auf, dass von den oben genannten Dingen nichts erwähnt wird. Ist das aus Ihrer Sicht eine transparente Aufklärung?
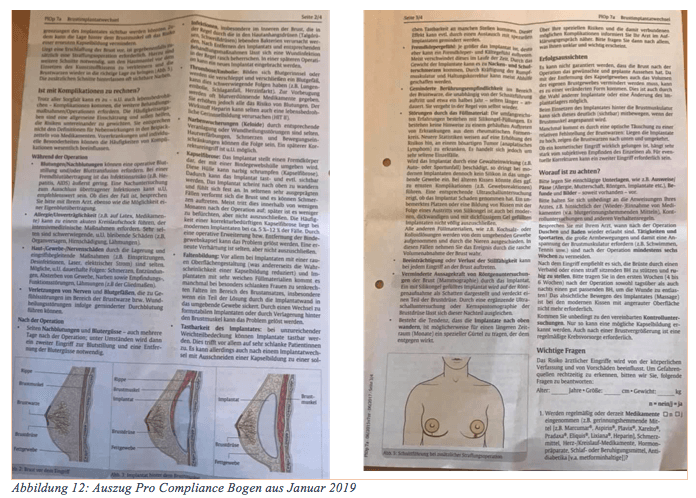
Aber werfen wir einen Blick in den „Pro Compliance Bogen“, den der Arzt nur auszuhändigen hat, nicht aber mit dem Patienten zu besprechen. Es ist nicht länger hinnehmbar, dass wichtige neue Erkenntnisse nicht enthalten sind. Ein Vergleich mit einem Bogen aus 2010 zeigt, dass auch in den letzten Jahren keine patientenschützenden Ergänzungen vorgenommen worden sind.
Es wird gesprochen von Infektionen, Thrombose, Narbenwucherungen, Kapselfibrose, Faltenbildung, Tastbarkeit des Implantats, Fremdkörpergefühl, geminderte Berührungsempfindlichkeit, Stillfähigkeit, Wandern des Implantats und Röntgenbeeinträchtigung. Der Hinweis auf ALCL wird als sehr selten abgetan und Rheuma sei ausgeschlossen. Noch einmal zur Erinnerung an die Frage nach dem Verschulden in Bezug auf Eigenbeteiligung und die Angaben bei der FDA. Bis zu 20 % Gelenkschmerzen – aber Rheuma sei ausgeschlossen. Nach den Erkenntnissen neuester Studien gilt aber folgende Aussage: "Das Risiko, dass Frauen mit Brustimplantation eine Autoimmunerkrankung entwickeln, war 45 Prozent höher als bei Frauen ohne Implantate!" Zusammenfassung der Studie, die Ihnen durch die Veröffentlichung von Dr. Cohen Tervaert bekannt sein sollte. „Wir haben 24.651 SBI-Empfänger und 98.604 passende SBI-freie Frauen aufgenommen. Der angepasste OR zwischen den SBIs und der Diagnose einer Autoimmun-/Rheumatisierung betrug 1,22 (95% CI 1,18-1,26). Die stärkste Assoziation mit SBIs (OR > 1,5, p < 0,001) wurde für das Sjögren-Syndrom, die systemische Sklerose (SSc) und die Sarkoidose (OR von 1,58, 1,63 bzw. 1,98) festgestellt. Ähnliche Ergebnisse wurden berechnet, wenn die Analyse auf Frauen ohne Brustkrebsgeschichte beschränkt war. Ein multivariables Cox-Regressionsmodell ergab eine HR von 1,45 (95% CI 1,21-1,73) für die Diagnose von mindestens einer Autoimmun-/Rheumastörung bei Frauen mit SBI im Vergleich zu denen ohne.“ Wann wollen Sie diese Ergebnisse in Deutschland kommunizieren?
In diesem Zusammenhang stelle ich mir natürlich auch die Frage, was mit einem ungeborenen Kind im Mutterleib passiert. Wenn diese oben genannten Gesundheitsrisiken mittlerweile bewiesen sind, wie lange dauert es, dass Schädigungen von Babys erkannt und kommuniziert werden. Dabei ist mit Sicherheit noch schwerer einen Zusammenhang zu erkennen, als es bei BII ohnehin schon ist.
Nutzen-Risiko-Verhältnis anhand von Risikomatrix ohne den Nutzen in die Bewertung einzubeziehen.
Die Risiken sind also hinreichend bekannt, aber es wird lediglich eine Schlussfolgerung bezüglich eines Nutzen-Risiko-Verhältnisses gefordert. Als Ergebnis soll es eine Risikobewertungsmatrix geben, die nach den Kriterien Eintrittswahrscheinlichkeit und Schweregrad des Schadens das Risiko bewertet. Mir scheint, hier wurde nicht von Anfang an gedacht. Wo wird der Nutzen in diese Bewertung einbezogen? Eine reine Risikomatrix ist zu kurz gedacht. Eine junge, vom Instagram-Idealbild getriebene Frau lässt sich ihre Brüste vergrößern und kann an BII, AISA oder BIA-ALCL erkranken oder sogar sterben? Ärzte spielen auch dieses Risiko herunter. Es gibt gerade mal 800 Fälle und „nur“ 19 Tote bei diesem durch Brustimplantat-assoziierten, anaplastischen großzelligen Lymphom (BIA-ALCL). Dass eine Frau ohne Implantate diese Krankheit aber gar nicht bekommen kann, wird einfach unter den Tisch gekehrt.
BaFin (Bundesanstalt für Finanzdienstleistungsaufsicht) im Vergleich zum BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte).
Ich möchte an dieser Stelle gerne einen Vergleich anführen. Versicherungsvermittler müssen ihre Provisionen offenlegen, ihrem Kunden mitteilen, wie viel Provision sie erhalten, ein Beratungsprotokoll ausfüllen, zahlreiche Dokumente (Kundeninformationsblatt, Produktinformationsblatt) aushändigen und der Kunde ist vor Falschberatung über die verpflichtende Vermögenschadenhaftpflichtversicherung des Vermittlers abgesichert. Ich kaufe als Verbraucher also z. B. eine Hausratversicherung für weniger als 150 € im Jahr mit „belanglosen“ Risiken und werde über jedes noch so kleine Detail aufgeklärt. Ein Versicherungsvertreter wird also streng kontrolliert und einem Arzt schenkt man vollstes Vertrauen: „Die Implantate seien bioverträglich, hielten ein Leben lang, seien die besten und neuesten, „Made in Germany“ und die einzige Gefahr sei eine Kapselfibrose.“ Die Risiken werden heruntergespielt und nicht ausreichend protokolliert. Es geht um die Gesundheit von ca. 60.000 Frauen (Tendenz steigend) pro Jahr allein in Deutschland, die sich Implantate einsetzen lassen, und das Milliardengeschäft boomt. Aufklärung = ungenügend! Ich frage mich, wie gewissenhaft das BfArM seine Aufgabe wahrnimmt. Mir scheint, als sei der Schutz der Pharmaindustrie wichtiger als die Gesundheit. Nachvollziehbar, wenn man das Ziel Wirtschaftswachstum eher verfolgt als gesunde Bürger, schließlich wirkt beides, Implantate einsetzen lassen und Krankheit heilen, positiv auf das BIP. Bei durchschnittlich 6.000 € pro OP sind dies immerhin 360.000.000 € Mio., ohne die Krankheitskosten gerechnet. Beim Blick in die EU stelle ich fest, dass dort der Fehler beginnt. Warum liegt die Verantwortung in Brüssel für Medizinprodukte im Industriekommissar an Stelle im Gesundheitskommissar?
Fürsorgepflicht des Bundesgesundheitsministeriums ist nicht weitreichend genug.
Ich habe auf der Seite des Bundesgesundheitsministers gelesen, dass die Betreiberpflichten bei Implantaten „bereits“ seit 2014 verschärft wurden. „Zur Stärkung der Patientensicherheit wurden die in der Medizinprodukte-Betreiberverordnung niedergelegten Anforderungen an implantierende Einrichtungen bereits im Jahr 2014 erhöht: Danach erhalten alle Patientinnen und Patienten, denen „...“ Brustimplantate implantiert werden, eine Patienteninformation, welche die für die Sicherheit des Patienten notwendigen Verhaltensanweisungen umfasst und einen Implantatepass enthält, der u. a. die Bezeichnung, Art und Typ sowie die Seriennummer des Implantats führt. Mit dem Implantatepass wird ein zweites Sicherheitselement geschaffen, das eine Ergänzung zum Medizinprodukte-Vigilanzsystem darstellt. Denn die Patienten können etwa bei entsprechenden öffentlichen Warnungen nun auch selber kontrollieren, ob ihr Implantat von einer korrektiven Maßnahme betroffen ist.“
Klasse! Ich gehörte zu so einer korrektiven betroffenen Maßnahme. Meine zweiten Implantate, die ich erst 2015 erhielt, hatten eine öffentliche Warnung erhalten. Frankreich hat den Verkauf verboten, weil sie in Verdacht stehen, BIA‑ALCL auszulösen. Da ich mich aktiv mit diesem Thema beschäftige, habe ich natürlich diese Information erhalten, aber, kann ich hier nicht erwarten, dass ich automatisch informiert werde? Wie sehen Ihrer Ansicht nach die erwähnten notwendigen Verhaltensanweisungen aus, die für die Sicherheit des Patienten sorgen? Welche Informationen sollten einem Patienten bei so einer folgenschweren Entscheidung zur Verfügung gestellt werden? Was ist Ihre konkrete Empfehlung?
FDA empfiehlt drei Jahre nach Implantation ein MRT und dann alle zwei Jahre zur Kontrolle.
Die FDA empfiehlt ein MRT drei Jahre nach Einsetzen der Implantate und dann alle zwei Jahre, damit eine Ruptur (bei der Silikon mit verheerenden Folgen in den Körper gelangen kann, wie oben beschrieben) frühzeitig erkannt wird. Außerdem sagt sie, dass Implantate kein Leben lang halten und eine Art Krebs auslösen können. Wie in dem Beispiel oben gezeigt, gibt es noch zahlreiche Ärzte, die genau das Gegenteil behaupten. Die EU-Verordnung spricht von 15 Jahren. In Summe müsste also jeder Arzt einer Frau mit Mitte 20 wohl sagen: Alle 15 Jahre 6.000 € bis 7.000 € und alle zwei Jahre ein MRT für ca. 500 € auf eigene Kosten. Wo finde ich diese Informationen auf den Seiten der deutschen Behörden? Wann verpflichten Sie endlich Ärzte zu diesen Aussagen?
Bei einer Meldung zu BII an das BfArM wird das Risiko nicht von einer unabhängigen Stelle beurteilt, sondern vom Hersteller selbst.
Ich selbst bin von BII betroffen und melde deshalb einen Produktefehler beim BfArM. Daraufhin erhalte ich ein Schreiben mit dem Hinweis, dass der Hersteller sich bei mir melden wird, wenn ich innerhalb einer Woche meine Einwilligung dazu abgebe, anderenfalls passiert offensichtlich nichts. Außerdem wollen sie gemeinsam mit dem Hersteller eine Risikobewertung vornehmen. (den Missstand zur Risikobewertung habe ich bereits weiter oben erläutert). Ich fühle mich bei so einer Vorgehensweise in keiner Weise unterstützt oder ernstgenommen. Ich erwarte von einer unabhängigen Behörde, dass sie solche Vorkommnisse dokumentiert, auswertet und der Öffentlichkeit zugänglich macht. Wann stellen Sie sicher, dass alle relevanten Vorkommnisse ausgewertet, dokumentiert und kommuniziert werden?
Zulassung für Medizinprodukte erfolgen nicht durch eine unabhängige Stelle.
Mittels Konformitätsbewertung oder dem Äquivalenzprinzip werden weitere Implantate zugelassen, die schwerwiegende Gesundheitsschäden verursachen. Silikon, wie schon häufig erwiesen wurde, löst sich leider meistens erst nach ein paar Jahren auf. Wie können Sie also wissen, dass das neue Brustimplantat sicher ist und Silikon nicht in den Körper gelangt, wenn es so viele Beispiele von Silikon in Lymphknoten gibt? Ich nahm an, dass die Zulassungskriterien bei der FDA katastrophal sind. Der Film „The Bleeding Edge“ zeigt diesen Missstand in den USA eindrucksvoll auf. Wenigstens fordert die FDA Langzeitstudien, wofür sich die EU offensichtlich nicht interessiert. Vielmehr werden Herzschrittmacher vom British Standards Institution (BSI) im Vereinigten Königreich zugelassen, nachdem der TÜV in Deutschland die Zulassung untersagt hatte. Es gab Todesfälle! Über die Zulassung eines Orangennetzes als Beckenbodennetz muss ich nicht noch einmal ausführlich eingehen. Wie lange will die EU noch tolerieren, dass so viele Gesundheitsschäden die Folge solcher „laschen“ Zulassungen sind?
Wenn ich jetzt noch tiefer in die Recherche einsteige, wer TÜV und Dekra finanziert, werde ich mit Sicherheit nicht akzeptable Zustände offenlegen. Wie kann es also sein, dass krankmachende Medizinprodukte, die nun wirklich bei kosmetischen Operationen keinen „hohen“ Nutzen haben und bei Wiederaufbau nach Krebs wie selbstverständlich genutzt werden, weiterhin zahlreich zugelassen werden? Der Hinweis, dass die Symptome der erkrankten Frauen auch auf andere Krankheiten zurückgeführt werden können, wird nicht länger tragbar sein.
BII ist heilbar. Deshalb sollte eine Explantation als medizinisch notwendige Heilbehandlung gelten.
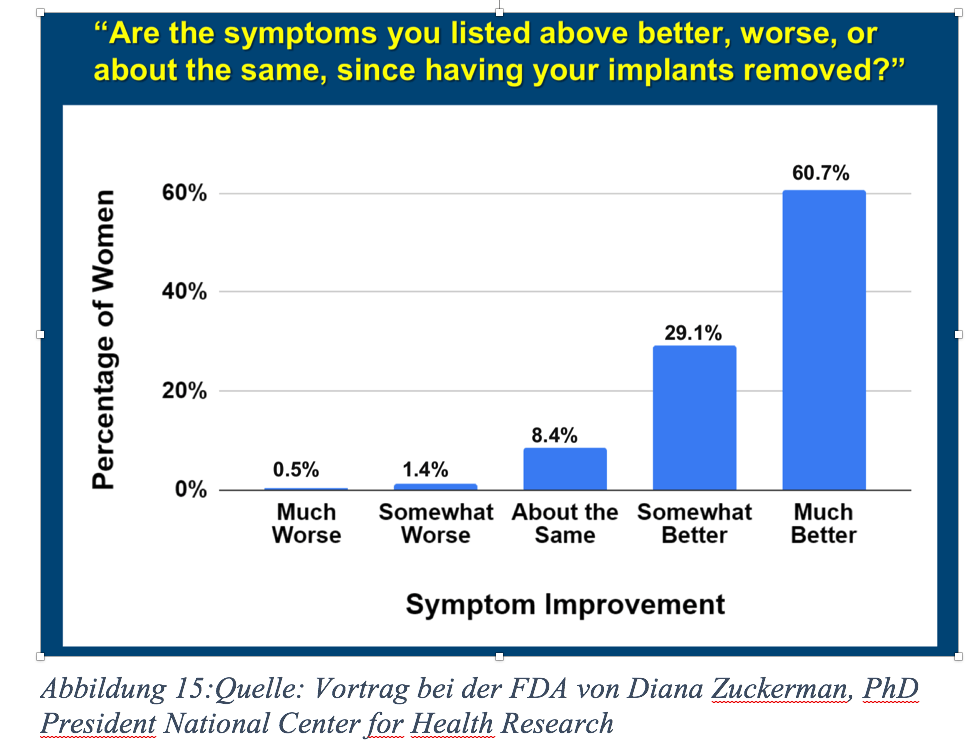
Wie Sie bei der Anhörung der FDA mitbekommen haben, gibt es mittlerweile ein paar Mediziner, die aus Überzeugung nur noch explantieren, sich für wissenschaftliche Studien engagieren und die Existenz von BII nicht anzweifeln. Außerdem belegen sie, dass bei fachgerechter Enbloc‑Entnahme der Implantate die Heilung von BII möglich ist. Dr. Victor Urzola dokumentiert Heilungsraten von bis zu 85 % nach sechs Monaten. Bei der FDA-Anhörung haben Sie dazu auch Statistiken gesehen. Das Ergebnis einer Studie aus Israel mit 449 Frauen, die in den Jahren 2016, 2017 und 2018 aufgrund diverser gesundheitlicher Probleme eine Explantation vorgenommen hatten, zeigt deutlich eine Verbesserung der Symptome nach Entnahme der Implantate.
Aufgrund fehlender Aufklärung laufen noch heute zahlreiche Frauen von Arzt zu Arzt und versuchen herauszufinden, woher ihre vielfältigen Beschwerden (Hautreaktionen nach Einsetzten der Implantate, rheumatischen Erkrankungen, Schwindel, Kopfschmerzen, Nackenschmerzen, Muskel- und Gelenkschmerzen, etc.) kommen und hören immer wieder: „Sie sind gesund.“ Wann sorgen Sie endlich für Aufklärung?
Auf jeder Zigarettenschachtel ist in Deutschland ein grausames Bild abgedruckt. Es gibt also einfache Möglichkeiten, zu sensibilisieren.
Mein Schreiben ist mühevoll recherchiert und ausführlich geschrieben. Jedoch ist der Kontext auch nur durch Lesen der Überschriften zu verstehen ist. Ich hoffe, dass vielbeschäftigte Politiker die Zeit finden, wenigstens die Überschriften und die Folgeseite (unserer Forderungen) persönlich zu lesen.
Ich erwarte Ihre Antworten baldmöglichst.
Mit freundlichen Grüßen
Wir fordern Sie auf:
- Verpflichtende Mitteilung sämtlicher Inhaltsstoffe von Brustimplantaten in einfacher verständlicher Form für die implantierenden Ärzte und Frauen vor dem Eingriff
- Schaffung von transparenten Zugangsmöglichkeiten zum Medizinprodukteinformationssystem, auch für Patienten
- Ergänzung des geplanten Implantateregisters, um relevante Informationen jeder Implantation, damit bei einer Rückrufaktion unverzüglich und zentral gehandelt werden kann. Weiterhin sollten in diesem Register die Meldung von Vorkommnissen statistisch auswertbar sein.
- Unterstützung bei der Sammlung von Beweisen zur Existenz von BII, ALCL, ASIA und anderen gesundheitlichen Vorkommnissen in Verbindung mit Brustimplantaten, z. B. in Form einer zentralen Meldestelle. Eine Risikobewertung mit dem Hersteller kann nicht als „Schutz des Verbrauchers“ gesehen werden.
- Transparenzschaffung über gesundheitliche Risiken durch ein öffentliches Verzeichnis mit Auswertungen zu den bekannten Risiken zum Nachlesen für Patienten
- Einführung einer sogenannten Packungsbeilage mit Mindestangaben über Datum der CE-Zertifizierung, Anzahl verkaufter Produkte, Inhaltsstoffe, Risiken auch von Vergleichsprodukten anderer Hersteller
- Einführung einer transparenten Beratungsdokumentation (Aufklärung über Risiken, Meldestellen, Haltbarkeit, Inhaltsstoffe, etc.), die vom Patienten und implantierendem Arzt zu unterschreiben ist
- Einführung strengerer Zulassungskriterien für Deutschland. Keine Zulassung durch Dekra oder TÜV, die häufig Partner von Herstellerunternehmen sind.
- Forderung von Langzeitstudien nach Zulassung von Brustimplantaten nach dem Vorbild der FDA
- Einführung einer rechtsverbindlichen Pflicht über die Meldung von Problemen bei Implantaten. Bei Nichteinhalten sollten mindestens Geldstrafen auferlegt werden.
- Übernahme der Kosten und Folgekosten durch die Gesetzliche Krankenversicherung bei Entnahme des Medizinproduktes, wenn der Patient unter BII, ALCL oder ASIA leidet. Sofortiger Verzicht auf Anwendung des § 52 (2) SGBV aufgrund diverser neuer Erkenntnisse in den Jahren nach 2007
- Wechsel der Zuständigkeit für Medizinprodukte vom Industriekommissar zum Gesundheitskommissar in Brüssel